Мило гігроскопічна речовина – універсальний миючий засіб. На етапі прийняття рішення про закупівлю мила, враховується не тільки вигідна ціна, але і якість мила. Як же людині, яка не знає тонкощі виробничого процесу миловаріння визначити якість готового мила?
Відповідь проста: гарне мило зварене з кращих сортів жирів, а саме тваринного походження. Якісне мило виробляється з натуральних рослинних олій: кокосової, лляного, бавовняного, пальмового. Отже жирні олії виділяють з рослинних продуктів, а також тварин, наприклад зі свинячого сала або риб’ячого жиру.
А низькосортне мило виготовляють відповідно зі штучних замінників – це каніфоль або нафтенові кислоти (продукти переробки нафти). Надлишковий вміст штучних компонентів в милі перетворює пухнасту мильну піну в липку суміш, мило липне не тільки до рук, але й залишає липкий наліт. Особливо така ситуація з господарським милом.
На якість мила впливає процентний вміст у ньому жирних кислот, вищий сорт завжди має високе значення.
Мило проводиться шляхом кип’ятіння у воді жирних олій з лугами. В якості лугу йде Каустичний поташ і каустична сода. Під час кип’ятіння утворюються гліцерин і солі жирних кислот, тобто мив або мильний клей. Він вимагає видалення домішок і на цьому етапі важлива ступінь очищення. Домішки видаляють соляним розчином. Якщо мило погано очищено, то воно не дає хорошу піну, а так само може викликати подразнення шкіри.
З отриманого після очищення мильного шару і виробляють різні сорти мила.
Мило справляється з забрудненнями за рахунок вмісту в ньому луги, яка нейтралізує жир та інші забруднення. Луг вступає в реакцію з солями забруднень, під час хімічної реакції, мило змінює поверхневий натяг води, утворюються негативно заряджені іони, які відскакують від поверхні, що очищається. А мильні молекули обволікають частинки бруду і перешкоджають тому, що б бруд не прилипла знову. Далі змиваються мильною піною, з цього піна так важлива, немає піни – погано змито забруднення. Забруднюючі частки застряють в піні і змиваються водою.
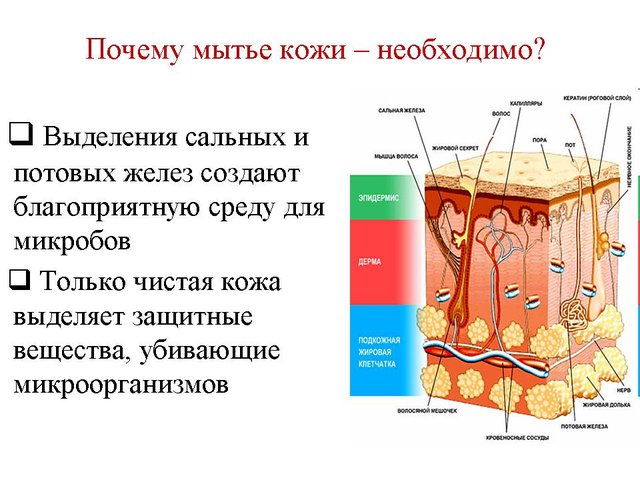
Добавки, що є в милі надають йому ті чи інші корисні властивості і призначення (відбілювання, зволоження, очищення і т.д).
Тверде мило отримують з насичених жирів. Для цього рідкі рослинні олії за допомогою водню насичують до твердих насичених жирів. Для рідкого мила, навпаки, застосовують рідкі масла. Крім твердого та рідкого мила, є ще й порошкоподібну мило або так звана мильна стружка.

Для довідки:
МИЛА, солі вищих жирних (С8-С18), нафтенових і смоляних кислот; одні з основних миючих засобів. Технічні суміші водорозчинних (калієвих, натрієвих, амонієвих і три-етаноламмоніевих) солей цих кислот називаються лужними милами, водонерозчинні солі, що містять метали II, III та ін. Гр. (наприклад, Са, Mg, Ni, Mn, Al, Co, Pb і ін.) – металевими.
Лужні мила отримують головним чином з стеаринової, пальмітинової, лауриновой, олеїнової, нафтенових кислот, каніфолі і талової олії.
Індивідуальні солі вищих жирних кислот – кристалічні речовини; щільність близько 1,05 г / см3, температура пл. 225-260 ° С. Залежно від умов кристалізації мила існують в моноклінної або ромбічної формі; остання характеризується кращою розчинністю у воді. При наявності в милах незначних кількостей води температура плавлення знижується до 100 ° С. Солі ненасичених жирних кислот краще розчиняються у воді і важче кристалізуються, ніж солі насичених. Безводні мила гігроскопічні; їх гігроскопічність залежить від природи кислотного залишку і пов’язаного з ним катіона. При підвищених температурах мила і вода змішуються в усіх відношеннях; при кімнатній – водні розчини мив утворюють тверді гелі, що містять воду, максимальна кількість якої залежить від природи жирної кислоти і іона металу. При певній концентрації мила утворюють міцелярні розчини і проявляють макс. миючий дію. Важлива характеристика мив – концентрація, при якій відбувається утворення міцел, називається критичною концентрацією мецеллообразованія. В області критичної концентрації властивості розчинів мив (поверхневий натяг, електрична провідність, осмотичний тиск і ін.) Різко змінюються.
Зі збільшенням молекулярної маси розчинність мила у воді зменшується. Розчинність в високомолекулярних милах підвищується в присутності низькомолекулярних. Залежно від природи катіона мила по розчинності у воді розташовують у ряд: NH + 4> К +> Na +> Li +. Мила у водних розчинах гідролізуються. З підвищенням температури і зниженням концентрації, і величини рН гідроліз посилюється: водні розчини мив мають лужну реакцію. Зі збільшенням молекулярної маси здатність мила до гідролізу зростає, причому мила насичених жирних кислот піддаються гідролізу сильніше, ніж ненасичених; додавання лугу до розчину мила пригнічує гідроліз. Під дією мінеральних кислот мила розкладаються з виділенням вільних жирних кислот.
Молекули мила, адсорбируясь на межі розділу фаз, знижують поверхневий натяг. У водних розчинах мила характеризуються рівноважними переходами: молекулярний розчин ⇌золь ⇌гель, що характерно для полуколлоідов (семіколлоідов). Освіта міцелярних розчинів мила спостерігається вище деякого критичного значення температури – так званої точки Крафта, яка зазвичай трохи нижче температури плавлення твердого мила. При температурах нижче точки Крафта гідратована тверде мило утворює набряклий гель, рівноважний з істинним розчином, в точці Крафта – колоїдні частинки-міцели; при цьому загальна растворімостьмила значно зростає. Зі збільшенням молекулярної маси мила точки Крафта зміщуються в область більш високих температур.
За способом отримання мила ділять на клейові, ядрові і пілірованние, за цільовим призначенням: на господарські, туалетні, технічні, спец. і медичні, по товарній формі: на тверді, рідкі та пастоподібні.
Процес отримання мив (миловаріння) складається з варіння мила і надання йому товарного вигляду (охолодження, формування, штампування, упаковка). При варінні мила вихідні жири обмилюють водним розчином NaOH при кип’ятінні з останнім нейтралізацією продукту омилення (жирні кислоти) розчином Na2CO3 при кип’ятінні і інтенсивному перемішуванні; при цьому нейтралізується до 70% жирних кислот. Решта жирні кислоти і нейтральні жири обробляють розчином лугу. На цій стадії утворюється концентрований розчин (так званий мильний клей), в якому підтримується певний надлишок лугу (приблизно 0,2%) для придушення гідролізу. Клейові мила отримують шляхом охолодження концентрації водних розчинів мила без порушення однорідності розчину; вони містять 30-50% основної речовини. Охолоджену масу ріжуть на шматки.
У процесі отримання ядерного мила в мильний клей вводять концентрований розчин електроліту (NaCl, NaOH). При цьому відбувається висолювання мила і маса розділяється на два шари. Верхній шар являє собою очищене мило- “ядро” з вмістом мила після відстоювання не менше 60%. Нижній шар, так званий подмильний луг, являє собою розчин електроліту, що містить невеликі кількості мила, домішки, присутні у вихідній сировині, а також гліцерин (при отриманні мила з нейтральних жирів). З під-мильного лугу витягують мила і гліцерин. Виділене “ядро” очищають і освітлюють промиванням розчином електроліту.
Пілірованное мило – вищий сорт мила; отримують з ядрового шляхом висушування останнього перетиранням на вальцях спеціальної (пілірной) машини. Вміст основної речовини в такому милі підвищується до 72-74%, поліпшується структура мила, його стійкість до усихання, прогорканию і дії високих температур при зберіганні.
Господарське мило отримують охолодженням мильного клею, після чого плоскі тверді плити мила розрізають на різальних машинах на шматки, які маркують на автоматичних штамп-пресах, а потім упаковують в тару. Більш сучасні і продуктивні механізовані вакуумні установки для охолодження і формувань безперервної дії. Тверді господарські мила залежно від сорту містять 40-72% осн. речовини, 0,1-0,2% своб. лугу, 1-2% своб.карбонатов Na або К, 0,5-1,5% нерозчинного у воді залишку. Для виробництва твердого туалетного мила використовують “ядро”, зварене з кращої за складом жирової основи, що містить 72-80% тваринних жирів, кокосове масло або відповідні фракції синтетичних жирних кислот. У туалетне мило зазвичай вводять різні аромати і барвники.
Рідкі туалетні мила містять 18-20% калієвих або калієво-натрієвих мил у водно-спиртовому розчині (що містять С2Н5ОН 10-15%).
Порошкоподібні мила випускають як у чистому вигляді, так і в суміші з лужними електоролітамі (Na2CO3, триполіфосфат і силікати Na та ін.), Які додають для пом’якшення води; отримують в сушильно-розпилювальної вежі, що продувається повітрям, куди через розпилювальні форсунки або за допомогою обертового диска потрапляє гарячий водний розчин мила в суміші з електролітами. Застосування електролітів знижує витрату мила і підвищує ефект прання.
Господарське та туалетне мила – основні побутові миючі засоби. Технічні мила – загущающих компонент більшості мильних мастил, застосовуваних у вузлах тертя, а також захисних та ущільнювальних мастил.
Глосарій:
Гігроскопічність (від гигро … і грец. Skopeo – спостерігаю), властивість матеріалів поглинати (сорбувати) вологу з повітря. Гігроскопічністю володіють: змочувані водою (гідрофільні) матеріали капілярно-пористої структури (деревина, зерно та ін.), В тонких капілярах яких відбувається конденсація вологи; добре розчинні у воді речовини (харчова сіль, цукор, концентрована сірчана кислота та ін.), особливо хімічні сполуки, що утворюють з водою кристалогідрати. Кількість поглиненої пористим матеріалом вологи (гігроскопічна вологість, Wгіг.) Зростає із збільшенням вмісту вологи повітря, досягаючи максимуму при відносній вологості повітря 100%. Для деревини максимальна Wгіг. ~ 30% (по масі), для пшениці ~ 36%. Знання гігроскопічності матеріалу важливо для розрахунку процесів сушки і зволоження: гігроскопічність враховується при тривалому зберіганні і перевезенні матеріалів, особливо морем. Гігроскопічність пояснюється відсиріванню і навіть розпливанню ряду солей при зберіганні на повітрі. Деякі гігроскопічні речовини (наприклад, концентровану сірчану кислоту) застосовують для осушення повітря.
Миючий дію, властивість ПАР, диспергованих у воді або органічному розчиннику, очищати поверхні твердих тіл від забруднень. Найбільш поширені забруднення-масляні (жирові) плівки з впровадженими в них частинками пилу, сажі і т. П. До миючому дії відносять також очищення поверхні розділу вода-повітря, наприклад від нафти. На практиці миючий дію здійснюється багатокомпонентними сумішами ПАВ, зв. миючими засобами.
Міцелообразованіе, мимовільна асоціація молекул ПАР в розчині. В результаті в системі ПАР – розчинник виникають м і ц е л л и-асоціати характерного будови, що складаються з десятків дифільних молекул, що мають довголанцюгові гідрофобні радикали і полярні гідрофільні групи. У т.наз. прямих міщеллах ядро утворене гідрофобними радикалами, а гідрофільні групи орієнтовані назовні. Число молекул ПАР, що утворюють міцели, зв. числом агрегації; за аналогією з молекулярною масою міцели характеризуються і так званої міцелляряной масою. Зазвичай числа агрегації складають 50-100, міцелярні маси рівні 103-105. Утворені при міцеллообразованія міцели полідисперсні і характеризуються розподілом за розмірами (або числам агрегації).
Точка Крафта – нижній температурний межа міцеллообразованія йоногенних ПАР, зазвичай вона дорівнює 283-293 К; при температурах нижче точки Крафта розчинність ПАР недостатня для утворення міцел.
Поверхневий натяг – прагнення речовини (рідини або твердої фази) зменшити надлишок своєї потенційної енергії на межі розділу з іншого фазою. Визначається як робота, витрачається на створення одиниці площі поверхні розділу фаз (розмірність Дж / м2). Згідно ін. Визначенням, поверхневий натяг – сила, віднесена до одиниці довжини контуру, що обмежує поверхню розділу фаз (розмірність Н / м); ця сила діє тангенциально до поверхні і перешкоджає її мимовільного збільшення.
Клеї (адгезиви), композиції на основі речовин, здатних з’єднувати (склеювати) різні матеріали завдяки освіті між їх поверхнями і клейовий прошарком міцних адгезійних зв’язків.
Колоїдний розчин – це золь інакше ліозолі; колоїдний розчин – високодисперсна колоїдна система з рідкого або газоподібного дисперсійним середовищем, в обсязі якої розподілена інша фаза у вигляді крапельок рідини, бульбашок газу або дрібних твердих частинок, розмір яких лежить в межі від 1 до 100 нм.
Ефіри складні (переетерефікація) – продукти заміщення атомів водню груп ОН в мінеральних або карбонових кислотах на вуглеводневі радикали. Для многоосновних кислот розрізняють повні і кислі ефіри (наприклад., ROSO2OR ‘і ROSO2OH, ROCOCH2COOR’ і ROCOCH2COOH соответветсвенно, де R, R ‘- алкіл, арил, гетерил). Ефіри складні нижчих карбонових кислот і найпростіших спіртов- безбарвні леткі рідини, часто з приємним фруктовим запахом; ефіри складні вищих карбонових кислот – тверді безбарвні речовини, майже позбавлені запаху. Нижчі еіфри складні мінеральних кислот (алкілсульфіти, алкілсульфати ,, алкілборати) – маслянисті рідини з приємним запахом; алкілсульфати, починаючи з С9Н17, – тверді сполуки температури кипіння ефірів складних нижчих спиртів нижче, ніж відповідних к-т; температури кипіння сульфатів зазвичай нижче, ніж сульфатів. Ефіри складні погано розчиняються у воді, добре – в органічних розчинниках, володіють значним дипольним моментом ( 5,67 х 10-30- 6,66 х 10-30 Кл х м).
Джерело довідки: http://www.xumuk.ru
Купити господарське мило 72 і туалетне (банний) мило можна так само тут …






